제조·수입 및 품질관리기준 적합성평가 절차도
제조·수입 및 품질관리기준 적합성평가 세부절차
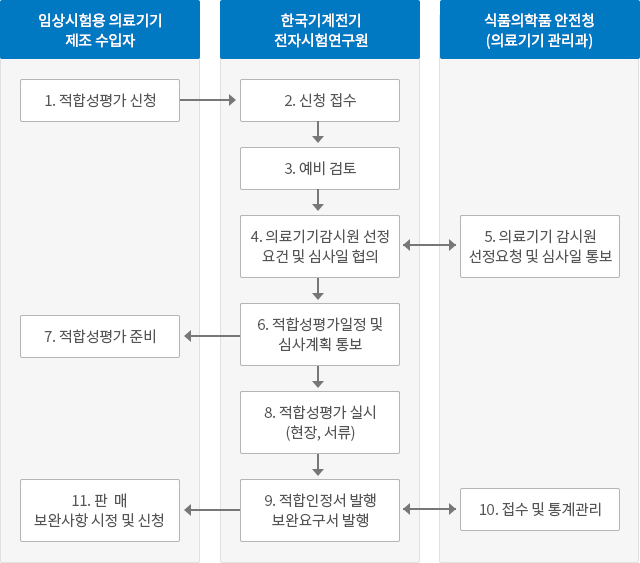
적합성평가 신청
- 임상시험용 의료기기의 제조·수입자는 임상시험실시전에, 의료기기제조·수입업자는 의료기기 제조·수입업의 허가 후 제품의 판매전에 품질관리기준의 적합성평가를 받아야 함
- 동일 품목군에 속하는 제품이라 하더라도 1등급에 2·3·4 등급을 추가하거나, 다른 품목군의 의료기기를 추가한 경우 새로이 적합성평가를 받아야 함
※ 1등급 의료기기(멸균의료기기는 제외한다)의 경우 별표1「의료기기제조및품질관리기준 적합성평가 기준 및 평가표」에 있어 4.1, 4.2, 5.5, 6.4, 7.1, 7.4, 7.5, 7.6, 8.2.1, 8.2.2, 8.2.3, 8.2.6, 8.3, 8.5의 사항만 적용
- 실시 현장심사대상(신규 제조소,정기갱신심사,제조소의 변경 또는 추가 시,신개발 의료기기, 최근 3년간 품질 부적합 안유문제 발생 시,서류 미제출 해외 제조소)
※ 대표자변경,등급상향,멸균추가는 심사대상이 아님
구비서류
- 의료기기 품질관리기준 적합인정 신청서
- 의료기기제조(수입)업 허가증 사본 또는 의료기기조건부제조(수입)업 허가증사본(임상시험용 의료기기는 제외)>
- 품질매뉴얼, 제품표준서 등 품질관리문서
※ 세부준비서류 목록은 신청서 작성방법 참조
신청접수
적합인정심사신청은 모든 품목군에 대하여 심사가 가능하나, 한국기계전기전자시험연구원에 소정의 신청서와 수수료가 납부되어야 신청접수가 된다.
예비검토
구비서류, 기재사항 등에 대하여 검토
※ 의료기기제조(수입)업 허가증 사본 또는 의료기기조건부제조(수입)업 허가증 사본(임상시험용 의료기기는 제외)이 구비되어야 함 경미한 보완사항은 신청인에게 통보 후 보완실시
의료기기감시원 선정요청 및 심사일 협의
한국기계전기전자시험연구원에서는 신청인이 요청한 심사 일을 고려하여 식약청과 의료기기감시원 및 심사 일을 협의한다.
의료기기감시원 및 심사일 통보
약청은 품질관리심사를 위한 의료기기감시원과 심사 일을 한국기계전기전자시험연구원에 통보한다.
적합성평가 일정 및 심사계획 통보
- 의료기기감시원과 심사일이 선정된 후 한국기계전기전자시험연구원은 심사일정 및 심사계획서를 신청인과 식약청에 통보한다.
- 심사계획서(audit plan)은 다음의 사항을 포함하여 작성
- 심사일자
- 심사의 범위와 목적
- 심사단의 구성
- 세부심사계획 및 소요시간
- 제조·업자 및 품질관리책임자 등 참여인원
적합성평가 실시
-
- 시작회의
- · 의료기기 제조·업자, 품질책임자를 포함한 심사에 참여하는 종업원과 의료기기감시원, 한국기계전기전자시험연구원 품질심사원 간 소개
- ※ 제조대표자 또는 경영책임자는 반드시 시작회의, 경영검토 및 종결회의에 참석
- ※ 컨설팅 관계자, 다른 제조·수입업자 등은 원칙적으로 심사에 참여할 수 없음. 다만, 적합성평가 대상 제조업자 및 식약청이 동의한 경우 다른 제조·수입업자는 심사에 참여할 수 있음
- · 심사 범위 및 목적의 확인
- ※ 제조 또는 임상시험용 의료기기 여부, 최초심사,정기갱신심사 또는 변경심사 여부 등
- · 심사일정 및 절차에 대한 설명
- · 심사팀과 제조업자의 공식적 의사소통 관계 설정
- · 기타 의문사항의 해소
-
- 품질관리기준 적합성평가
- · 심사계획서(audit plan)에 따라 적합성평가 실시
- ※ 현장심사를 포함하여 품질문서 등 품질관리 현황에 대한 심사
-
- 심사단 종합평가회의
- · 의료기기감시원 및 품질심사원으로 구성된 심사단 회의
- ※ 의료기기 제조·수입업자, 컨설팅 등이 배제된 상태에서 심사단이 종합평가를 실시
-
- 종결회의
- · 심사단은 심사 관찰사항 및 보완사항에 대하여 제조·수입업자, 품질책임자 등에게 설명하고, 심사보고서를 정리하여 전달
- · 적합성평가표 작성, 의료기기감시원·품질심사원·대표자의 서명
-
- 적합인정서 및 보완요구서 통보
- · 종합평가 결과에 따라 한국기계전기전자시험연구원 내부결재 후 적합인정서 또는 보완요구를, 식약청 및 신청업체로 통보
-
- 보완사항 시정 및 판매 · 임상 실시시기
- · 적합인정서가 발행된 후 의료기기 판매 실시 또는 임상시험 실시가 가능함
- · 보완요구서가 발행된 경우 보완사항을 시정 제출
- ※ 적합성평가결과 보완사항이 있는 경우 1월 이내의 기한을 정하여 보완을 요구하며, 제조업자는 기한 내에 보완사항을 시정한 후 재검토를 공문으로 신청
담당부서 홈으로 바로가기
아래버튼을 클릭하시면 담당부서의 홈으로 바로 연결되며 각 업무의 담당자 연락처를 확인하실 수 있습니다.